화학식의 종류, 원자단, 공기의 평균 분자량, 공기 중 산소의 질량비, 과잉 공기율 계산, 퍼센트 수율, 공기 중 산소의 질량비
목 차
#화학식의 종류
화학식은 원소의 조성 및 각 원자들의 상대적인 수, 그리고 그 물질의 분자 속에 들어있는 각 원자의 실제적인 수와 그 화합물의 구조 등을 나타내며, 화학식은 실험식, 분자식, 구조식 등으로 분류할 수 있습니다.
실험식
실험식은 화합물속에 들어 있는 원자들의 상대적인 수를 나타내는 것이므로 이 식은 각 원소들의 상대적 몰수를 나타내기도 합니다.
분자식
분자식은 실험식에 내포된 사실뿐만 아니라 한 분자 속에 들어 있는 각 원소의 원자 수도 나타냅니다. 수소원자를 탄소원자의 배로 가지고 있는 분자는 공통적으로 CH2라는 실험식을 갖습니다. 따라서, 실험식이 같은 분자들을 구별하려면 화합물의 분자량을 알아야 하는데, 그 이유는 분자량이 실험식량의 정수배가 되기 때문입니다.
구조식
구조식은 분자속의 원자들이 어떤 방식으로 결합되어 있는가를 나타내며 이것으로부터 분자식과 실험식을 알 수 있습니다. 아세트산(식초) 의구 조식은 다음과 같습니다. 결국 아세트산의 구조식, 분자식 및 실험식은 다음과 같이 쓸 수 있습니다.

#원자단
두가지 이상의 원소가 적당한 원자 수로 결합하여 한 개의 원자와 같이 화학변화에서 옮겨 다니는 원자의 모임을 원자단 또는 기라고 합니다. 이들 원자단의 예를 들면 아래와 같습니다.
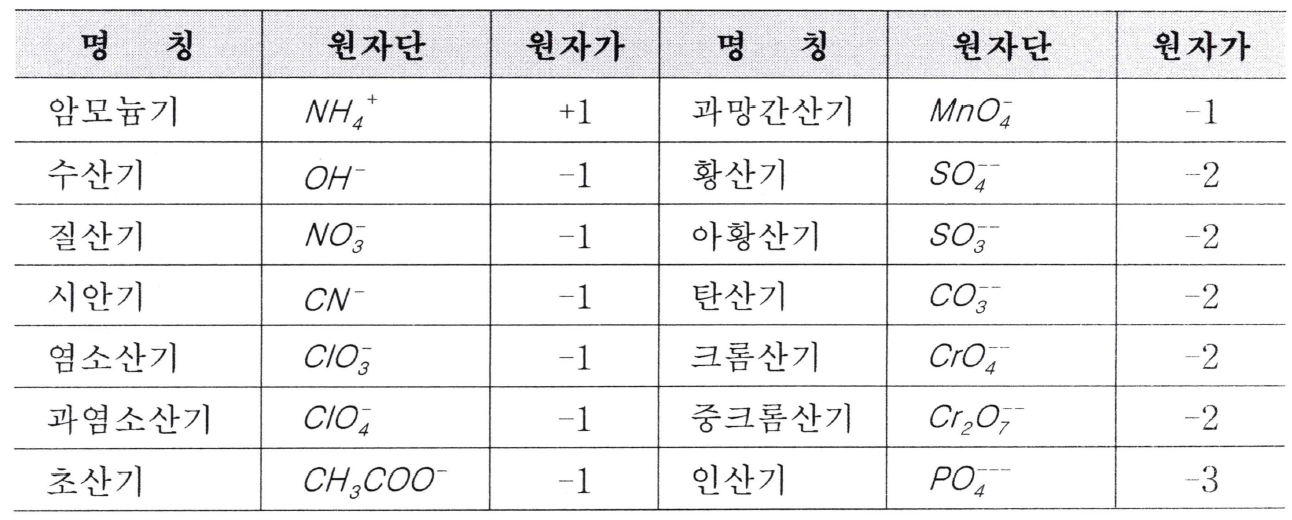
#공기의 평균 분자량
질소(N2), 산소(O2), 아르곤(Ar), 탄산가스(CO2)의 분자량은 각각 아래와 같습니다.
|
N2 : 14×2=28 |
O2 : 16×2=32 |
Ar : 39.95×1=29.95 |
CO2 : 12+16×2=44 |
이때, 공기의 성분비는 질소 78%, 산소 20.9%, 아르곤 0.95%, 이산화탄소 0.03% 나머지는 수소 헬륨입니다. 수소와 헬륨은 극히 미량이기 때문에 무시하고 공기의 평균 분자량은 다음과 같이 계산할 수 있습니다.
|
28×0.7803 + 32×0.2099 + 39.95×0.95+44×0.0003=28.95793 |
그러나 우리는 우주선을 쏘는 것이 아니기 때문에 통상적으로 평균 분자량 29로 계산해도 무방합니다.
#공기 중 산소의 질량비
앞서 대기 중 산소의 부피비는 21%(20.9)라고 알려드렸습니다. 이것은 Volume Percent(Vol%)이고 이번엔 대기중 산소의 질량비(wt%)를 계산해 보겠습니다. 100몰의 공기 중에 질소, 산소, 아르곤, 탄산가스는 위에 말한 비율대로 포함되어 있을 것이므로 100몰의 공기의 총질량은 다음과 같습니다.
|
N2 : 0.7803×28=21.8484 |
O2 :0.2099×32=6.7168 |
Ar : 0.95×39.95=0.3795 |
CO2 : 0.0003×44=0.0132 |
위 질량들은 모두 합산하면 28.957이 되는데 이중에 산소 O2가 6.7168이므로 공기 중 산소의 질량비는 23.195% 가 됩니다.
|
6.7168÷28.95793×100%=23.195% |
#과잉 공기율 계산
시간당 100몰의 부탄과 5000몰의 공기가 연소 반응기로 공급된다고 하면 공급된 공기는 몇% 과잉일까요? 부탄과 산소와의 반응식은 다음과 같습니다.

이 반응식으로부터 1몰의 부탁을 완전히 연소하기 위해서 6.5몰(13/2)의 산소가 필요함을 알 수 있습니다. 그런데 공기 중에는 산소가 21 Vol% 밖에 없기 때문에 100몰의 부탄을 연소시키기 위해서 화학 양론적으로 필요한 공기의 양은 다음과 같습니다.

#퍼센트 수율
화학반응에서는 반응물에 의한 생성물의 질량 계산법을 알아봤습니다. 그런데 이런 계산은 반응이 단 한 가지 반응만 일어나고, 반응물이 모두 생성물로 전환되며, 모든 생성물을 수집할 수 있다는 가정에 근거한 것입니다. 이 가정에 의해 계산된 생성물의 양을 이론적 수율(Theoretical yield)라고 부릅니다.
이런 조건들은 실험실이나 공장에서는 실제로 충족될 수 없습니다. 일반적으로 수집된 생성물의 실제 수율(actual yield)은 보통 이론적 수율보다 작으며 이 둘 간의 비를 퍼센트 수율이라고 합니다.

이 글이 도움이 되셨나요?

Reference
1. 소방기술사 서브 노트 by 유인상
'방재영역 > 연소공학' 카테고리의 다른 글
| 화재와 기상의 관계(기상조건, 습도, 바람세기, 풍속) (0) | 2021.01.15 |
|---|---|
| 29. 탄소화합물(유기화합물)의 특성, 종류, 분자식 (0) | 2020.06.24 |
| 28. 연소한계와 최소 산소농도의 추정 (0) | 2020.06.19 |
| 27. 가연성 혼합기의 농도 표시법 (0) | 2020.06.18 |
| 26. Burgess-heeler의 법칙 (0) | 2020.06.17 |





댓글